Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака
Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
Уравнение аммиака:
2NH4Cl + Ca(OH)2 = NH3 + CaCl2.
После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
Именование «нашатырь» он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование «аммиак», которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза. Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Способы получения
В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
N2 + 3H2 ⇄ 2NH3 + Q
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
4. Или нагреванием хлорида аммония с концентрированной щелочью:
NH4Cl + NaOH = NaCl + NH3↑ + H2O
Что это такое?
Основное название — гидроксид аммония, в международном варианте — Ammonium Hydroxide. Это слабое соединение, полученное посредством смешивания аммиака с молекулами воды. Упоминается в ГОСТ Р 53045-2008, п.87.
Синонимичные названия:
- Е 527 (Е–527), европейский код;
- гидрат аммиака;
- гидрат окиси аммония;
- аммиачная вода;
- аммиак водный;
- едкий аммиак;
- едкий аммоний;
- нашатырный спирт;
- во Франции — hydroxid de ammonium;
- в Германии — Ammoniumhydroxid.
Виды
- Для пищевой, медицинской и косметической отраслей.
- Для сельскохозяйственной отрасли.
Описание и свойства
| Показатель | Стандарт |
| Внешний вид | Прозрачная бесцветная жидкость (иногда желтый оттенок). |
| Состав |
|
| Запах | Резкий характерный. |
| Растворимость | Высокая. |
| Содержание основного вещества | Не меньше 27%. |
| Вкус | Специфический. |
| Плотность | 0,91 (раствор 25%) г/см³. |
| Другое |
|
К какому классу относится?
Гидроксид аммония относится к регулятором кислотности и является сырьем синтетического происхождения.
Из чего и как получают?
Добавку Е527 получают путем соединения очищенной воды и аммиака. Для этого используются продукты сжигания каменного угля, после чего их растворяют в воде.
Процесс производства проходит в несколько этапов:
- дистилляция;
- дефлегмация;
- конденсация аммиачной воды.
Добавку Е527 производят российские предприятия:
- ОАО «Акрон» (город Великий Новгород);
- химическая (Тульская область);
- ОАО «Тольяттиазот».
Ведущие зарубежные производители:
- Knuchel Farben AG (Германия);
- Cutrin (Финляндия);
- Lubon Industry Co., Ltd.(Китай).
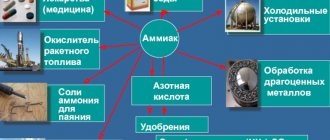
Применение
Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Как узнать, что гидроксид аммония есть в составе товара?
Всю информацию о наличии данной добавки производитель отражает на этикетке продукта, в конце списка, вместе с остальными регуляторами кислотности, эмульгаторами и консерваторами. Чаще всего ставится отметка Е527, а в скобках указывается расшифровка — гидроксид аммония.
Иногда Е527 можно встретить под названием гидрат аммиака или гидрат окиси аммония. На иностранной продукции используется международное название Ammonium Hydroxide или европейский код Е-527. В медицинских препаратах добавка отмечается как нашатырный спирт.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака
Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
NH3 + HCL = NH4CL
NH3 + H2SO4 = (NH4)2SO4
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
- С водой образуется неустойчивый гидрат аммиака.
NH3 + H2O = NH3 × H2O
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
- С оксидами металлов.
2NH3 + 3CuO = 3Cu + N2 + 3H2O
- С галогенами.
8NH3 + 3Cl2 =N2 + 6NH4Cl
- С солями металлов.
3NH3 + ЗН2О + AlCl3 = Al(OH)3↓ + 3NH4Cl
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния
Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
МОРФОЛОГИЯ
Кристаллы тетрагонально-триоктаэдрического, ромбо-додэкаэдрического, реже кубического габитуса, обычно удлинены по L3 или L4 и имеют псевдотригональный или псевдотетрагональный облик. Характерны удлинённые скелетные кристаллы, псевдотригональные дендриты.
Агрегаты – рыхлые землистые массы, пушистые игольчатые налеты; друзы кристаллов, сталактиты, полые наросты, натечные корочки. каплевидные формы в нишах и пещерах, веерообразные, шестоватые. ячеистые и параллельно-волокнистые агрегаты; иногда заполняет поры лавы, цементирует куски лавы, слагает устья некоторых фумарол.
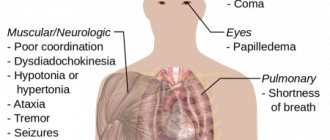
Отравление аммиаком
Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Как развести аммиак, чтобы получить нашатырный спирт: пропорции, процентное соотношение
Как мы уже сказали, не рекомендуется готовить раствор нашатырного спирта. Все же есть способ это сделать. Обычно такое средство используется в быту, чтобы избавиться от насекомых или устранить неприятные запахи на кухне. Для этого надо 1 часть нашатырного спирта смешать 9 частями воды. В процентном соотношении это выглядит следующим образом — 10% спирта и 90% процентов воды.
Более сложный способ чем-то напоминает приготовление медицинского спирта. Различие только в количестве компонентов.
Как сделать нашатырь самостоятельно?
Готовится вещество из водки. Но только недостаточно просто ее купить и заморозить. Это не даст нужного результата, а потому вам потребуется самогонный аппарат. Конечно, после его использования у вас получится что-то крепче водки, но все же не чистый спирт. Для его получения требуется перегонка водки.
Вам потребуется для этого:
- Кондитерские дрожжи
- Простой пакет
- Стеклянная банка
У вас все должно находиться под рукой. Итак, приготовление будет следующим:
- Вылейте сок или морс, который вы приготовили в стеклянную банку
- Добавьте к нему дрожжи. Рассчитывайте, что на 1,5 литра напитка добавляется 30 г дрожжей
- Хорошо смешайте состав и закройте крышкой
- Закрытую банку поместите на батарею
- Открывайте ее каждый день, чтобы выходил углекислый газ. Если этого не делать, то потом и не удивляйтесь, что ваша банка взорвалась
- Так делайте несколько дней, пока не выделится спирт. Чем дольше вы будете хранить банку, тем больше выделится спирта
- Через какое-то время смесь застынет и спирт можно будет слить
Чтобы убедиться, что у вас точно получился нашатырь, налейте немного жидкости в столовую ложку и снизу попробуйте нагреть. Она должна вспыхнуть.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Использование спирта
Основной сферой использования нашатыря являются медицина и промышленность. На основе NH 4 OH изготавливаются различные чистящие средства и отбеливатели. Сегодня, когда в повседневной жизни широко используются синтетические и технические материалы, необходимость в применении спирта нашатырного только увеличилась.
В сельском хозяйстве применяются различные удобрения, выполненные с использованием нашатыря. Регулярные подкормки на основе NH 4 OH позволяют обеспечить растения азотом и другими необходимыми им микроэлементами. Также при помощи таких составов производятся инсектициды и средства для уничтожения садовых и домашних насекомых.
Примочки на основе нашатыря отлично избавляют от суставной боли, уменьшают воспалительные процессы и помогают при хронических заболеваниях костей. Последние исследования доказали эффективность этого средства при грибковых болезнях ногтевых пластин. Наружное применение лекарственных средств на основе препарата помогает при миалгии, различных нервных расстройствах, головной боли и других патологиях.
Моногидрат аммиака применяется в косметологии, где на его основе изготавливаются мази и лосьоны для сухой кожи, а также ополаскиватели для волос.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Влияние на организм: опасно ли вещество или нет?
Есть ли польза?
Установленной пользы для человеческого организма у добавки гидроксид аммония не выявлено.
Возможный вред и меры предосторожности
Важно! При длительном вдыхании аммиачных паров человек может получить ожог дыхательных путей, поэтому с растворами следует обращаться осторожно, хранить в плотно закрытых тарах, при работе с ними необходимо надевать специальную маску и защищать глаза очками.
Аммиак — активный раздражитель, способный негативно влиять на слизистые пищеварительного тракта, нарушить функциональность работы печени и почек. Поэтому нельзя нарушать максимально допустимую дозировку, а при первых признаках недомогания следует сразу обратиться за медицинской помощью.
Не стоит забывать, что пары аммония в больших концентрациях являются легковоспламеняющимися и взрывоопасными. Пожары, возникшие из-за аммиака, эффективней всего тушить пеной из огнетушителя.
Допустимое суточное потребление
Е527 добавляется в продукцию по техническим инструкциям производства, часто в комбинациях с иными гидроксидными добавками. Для пищевой промышленности в какао и шоколаде норма Е527 не должна быть больше 70 граммов на 1 кг. В других отраслях показатель снижен до 50 г на 1 кг.
Последствия отравления
После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
Меры предосторожности
Необходимо соблюдать повышенную осторожность при использовании средства и не игнорировать индивидуальные средства защиты. Безопасность применения нашатыря будет во многом зависеть от следования простейшим правилам:
- разводить гидроксид аммиака следует на воздухе или в хорошо проветриваемом помещении;
- нужно избегать попадания нашатыря на кожу лица;
- хранят препарат в закрытом и недоступном для детей месте;
- вдыхать пары аммиака запрещено людям, которые страдают вегетососудистой дистонией;
- запрещается смешивать спирт с другими веществами.
При использовании нашатыря в качестве удобрения и подкормки для растений следует применять резиновые перчатки и специальную защитную маску. Если по какой-либо причине нерастворенный гидроксид аммиака попал внутрь, необходимо выпить большое количество воды, вызвать рвоту, после чего обратиться к врачу за помощью.